Angiopatía Amiloide Cerebral
INTRODUCCIÓN
La angiopatía amiloide cerebral (AAC) engloba un fenómeno clínico-patológico caracterizado por el depósito de amiloide en las capas media y adventicia de las arterias y arteriolas (y en menor medida venas) del córtex cerebral y las leptomeninges. Debido a estos depósitos, los vasos afectados son más susceptibles de sufrir hemorragias.
Además, es una de lesión característica en los pacientes con enfermedad de Alzheimer (EA), pero también se encuentra en cerebros de pacientes ancianos cognitivamente intactos.
PREVALENCIA
La verdadera incidencia es difícil de determinar puesto que el diagnóstico definitivo sólo puede realizarse mediante anatomía patológica. Series de autopsias han determinado que su existencia es rara en sujetos menores de 50 años y está presente en más del 50% de las personas mayores de 90 años, siendo la edad un marcador de riesgo determinante.
En pacientes con diagnóstico clínico de EA la incidencia varía entre el 80-90% (Ellis RJ et al 1996). También es particularmente frecuente en sujetos con síndrome de Down.
Se estima que la AAC es responsable del 15% de las hemorragias intracerebrales en pacientes mayores de 60 años y está presente hasta en la mitad de hemorragias intracerebrales lobares no traumáticas en los pacientes mayores de 70 años.
ETIOPATOGENIA
El término amiloide se utiliza para describir depósitos proteicos con unas características determinadas (configuración en sábana con plegamiento beta, estructura fibrilar, alta insolubilidad y birrefringencia bajo luz polarizada tras tinción con rojo Congo). La AAC se puede clasificar en función de la naturaleza de la proteína depositada incluyendo b-amiloide, cistatina, proteína priónica, transtiretina y otras (Pezzini A. 2009).
Aunque en la gran mayoría de los casos el depósito de amiloide ocurre de forma esporádica, se han identificado variantes hereditarias en las que mutaciones genéticas específicas producen patrones de herencia autosómico dominantes (Revestz T 2009). El fallo molecular producto de las mutaciones afectaría a las vías proteolíticas con el consecuente depósito de amiloide.
Además, se ha determinado que los polimorfismos ApoE2 y ApoE4 se asocian con una mayor prevalencia y severidad de AAC. El alelo ApoE2 confiere un mayor riesgo de hemorragia intracerebral, mientras que el ApoE4 se asocia con mayor riesgo de EA concomitante.
El mecanismo exacto por el que este depósito produciría una mayor predisposición a la ruptura de los vasos está aún por determinar.
La hemorragia cerebral en pacientes con AAC puede ser espontánea o estar asociada a hipertensión arterial, arteriosclerosis, traumatismos, intervenciones neuroquirúrgicas o uso de tratamientos antiagregantes o anticoagulantes.
PRESENTACIÓN CLÍNICA
La AAC es normalmente asintomática, pero se puede presentar como varias entidades clínicas, siendo la hemorragia cerebral y el deterioro cognitivo las más frecuentes.
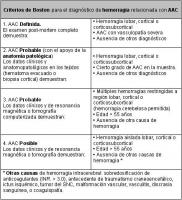
- Hemorragia cerebral asociada a AAC: las hemorragias lobares son la manifestación más frecuente de la AAC, y pueden extenderse desde el córtex hasta el espacio subaracnoideo y de forma menos común abrirse a ventrículos. Pueden ser únicas o múltiples y recurrentes (entre un 25-40% de los casos). La mortalidad asociada es menor que en las hemorragias profundas de origen hipertensivo. La mayor parte de los pacientes con hemorragias intracerebrales secundarias a AAC no tienen EA. Dada la elevada frecuencia de esta forma de presentación se han establecido unos criterios para determinar la probabilidad de que una hemorragia sea de origen amilodeo (Katherine A. 2001) (Ver Tabla Criterios de Boston AAC jpg)
- Demencia asociada a AAC: se puede presentar con distintos patrones de deterioro cognitivo: desde curso agudo o subagudo hasta una progresión más lenta presente en los pacientes con EA (Greenberg SM 1993). Aunque la AAC puede contribuir a la neurodegeneración propia de la EA, no se ha establecido una relación causal directa entre ambas entidades.
- Síntomas neurológicos focales transitorios: generalmente consisten en debilidad, hipoestesia o parestesias que pueden diseminarse a áreas contiguas y diferentes territorios vasculares y desaparecer en varios minutos. Probablemente sean secundarios a hemorragias petequiales que producen crisis parciales o fenómenos de depresión neuronal similares a los presentes en las migrañas. En ocasiones pueden presentarse como cuadros confusionales o alteraciones visuales transitorias.
- Leucoencefalopatía posterior reversible: se han descrito múltiples casos de deterioro cognitivo subagudo, crisis comiciales y cambios de neuroimagen asociados a cambios histológicos diagnósticos de AAC. Estos pacientes pueden mejorar con tratamiento corticoideo (K. A. C. Harknessa 2004).
- Otras formas de presentación: la AAC puede asociarse a ictus isquémicos pero no hay evidencia de una relación causal clara. En ocasiones la AAC puede presentarse con un acúmulo excesivo de amiloide con efecto masa sobre el parénquima cerebral conocido como amiloidoma.
Tabla: Criterios de Boston para el diagnóstico de angiopatía amiloide como causante de hemorragia cerebral.
DIAGNÓSTICO
Aunque el diagnóstico definitivo sólo puede realizarse mediante análisis histológico, la neuroimagen y los datos clínicos asociados pueden darnos un diagnóstico de presunción fiable.
- Neuroimagen:
TAC Craneal: la presencia de una hemorragia lobar y afectación cortical con o sin extensión a espacio subaracnoideo o apertura a ventrículos es sugestiva de hemorragia cerebral asociada a AAC. Con escasa frecuencia la hemorragia puede afectar también a estructuras profundas. En pacientes con deterioro cognitivo puede presentarse además leucoencefalopatía difusa y atrofia parenquimatosa (Miller JH 1999).
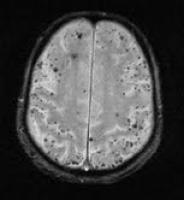
RMN Craneal: es característica la presencia de múltiples hemorragias petequiales corticales y subcorticales incluso en pacientes asintomáticos. Las secuencias ponderadas en T2* (ECO-gradiente) muestran depósitos de hemosiderina que corresponden a hemorragias antiguas (Greenberg SM 1996, Feldman H 2008).
Figura: depósitos de hemosiderina en resonancia magnética craneal ponderada en secuencia T2* (ECO gradiente).
Angiografía: los hallazgos son anormales sólo en un reducido número de casos de vasculitis asociada a AAC. Dado que las características clínicas de la vasculitis y la angiopatía amiloide se solapan, sólo estaría indicada la realización de angiografía ante un alto índice de sospecha. Además, el diagnóstico definitivo de vasculitis precisaría diagnóstico histológico mediante biopsia.
Tomografía de emisión de positrones (PET): aunque en el momento actual no está disponible en la práctica clínica habitual, la retención cortical del compuesto Pittsburgh B podría ser de utilidad como marcador in vivo de AAC (Ly LV, 2010).
- Hallazgos histológicos: El diagnóstico definitivo es histológico mediante la demostración de amiloide en la pared del vaso. Las muestras pueden obtenerse mediante evacuación del hematoma, biopsia o autopsia. El proceso patogénico puede ser difuso por lo que los hallazgos histológicos pueden estar ausentes en determinadas muestras histológicas.
El b-amiloide es un material homogéneo, intensamente eosinofílico. Cuando se tiñe con rojo Congo y se visualiza con microscopio de polarización produce una birrefringencia con aspecto verde-amarillento (verde-manzana) característica. Cuando se utilizan tioflavina T y S la visualización con luz ultravioleta, el amiloide es fluorescente.
MANEJO TERAPEUTICO
La AAC carece de tratamiento curativo hoy en día.
El manejo de las hemorragias intracerebrales asociadas a AAC es similar al tratamiento estándar de las hemorragias de otro origen.
Es importante tener en cuenta la predisposición de los cambios vasculopáticos a producir hemorragias cerebrales. Se deben valorar la retirada del tratamiento anticoagulante en pacientes con hemorragias intracerebrales asociadas a AAC especialmente si se demuestran hemorragias petequiales mediante neuroimagen. En cuanto al uso de antiagregantes es necesario valorar el balance riesgo/beneficio de su uso teniendo en cuenta el las posibilidades de sangrado/resangrado y su indicación profiláctica. Además, la presencia de microsangrados antiguos visualizados en secuencias T2* podrían ser un marcador de riesgo para hemorragia intracerebral en pacientes que reciban tratamiento trombolítico (Kidwell CS 2002).
BIBLIOGRAFÍA
- Ellis RJ, Olichney JM, Thal LJ, Mirra SS, Morris JC, Beekly D, et al. (1996). Cerebral amyloid angiopathy in the brains of patients with Alzheimer's disease: the CERAD experience, Part XV. Neurology. 46(6):1592-6
- Greenberg SM, Finklestein SP, Schaefer PW. (1996). Petechial hemorrhages accompanying lobar hemorrhage: detection by gradient-echo MRI. Neurology. 46(6):1751-4.
- Greenberg SM, Vonsattel JP, Stakes JW, Gruber M, Finklestein SP. (1993) The clinical spectrum of cerebral amyloid angiopathy: presentations without lobar hemorrhage. Neurology. 43: 2073 –79.
- H. H. Feldman, L. F. Maia, I. R.A. Mackenzie, B. B. Forster, J. Martzke, and A. Woolfenden (2008). Superficial Siderosis: A Potential Diagnostic Marker of Cerebral Amyloid Angiopathy in Alzheimer Disease. Stroke. 39(10): 2894 - 2897.
- K. A. C. Harknessa, A. Colesa, U. Pohlb, J. H. Xuerebb, J. C. Barona and G. G. Lennox. Rapidly reversible dementia in cerebral amyloid inflammatory vasculopathy Eur J Neurol. 2004, 11: 59–62.
-Katherine A. Knudsen, BA; Jonathan Rosand, MD; Diane Karluk,Clinical diagnosis of cerebral amyloid angiopathy: Validation of the Boston Criteria. Neurology 2001;56:537–539.
- Kidwell CS; Saver JL; Villablanca JP; Duckwiler G; Fredieu A; Gough K; et al. (2002). Magnetic resonance imaging detection of microbleeds before thrombolysis: an emerging application. Stroke. 33(1):95-8.
- Ly LV, Donnan GA, Villemagne VL, Zavala JA, Ma H, O'Keefe G, et al. (2010). 11C-PIB binding is increased in patients with cerebral amyloid angiopathy-related hemorrhage. Neurology. 74(6): 487 - 493.
- Miller JH, Wardlaw JM, Lammie GA. Intracerebral haemorrhage and cerebral amyloid angiopathy: CT features with pathological correlation. (1999). Clin Radiol. 54: 422–29.
- Oh U, Gupta R, Krakauer JW,Khandji AG, ChinSS, et al. (2004). Reversible leukoencephalopathy associated with cerebral amyloid angiopathy Neurology. 62:494–497.
- Pezzini A; Del Zotto E; Volonghi I; Giossi A; Costa P; Padovani A. (2009). Cerebral amyloid angiopathy: a common cause of cerebral hemorrhage. Curr Med Chem. 16(20):2498-513.
- Revesz T, Holton JL, Lashley T, Plant G, Frangione B, Rostagno A, et al. (2009) Genetics and molecular pathogenesis of sporadic and hereditary cerebral amyloid angiopathies. Acta Neuropathol. 118(1):115-30.
- 75494 lecturas