Clínico y diagnóstico del infarto medular
CLÍNICA
Consiste en una mielopatía dolorosa aguda que puede producir cualquier síndrome medular, excepcionalmente precedida por ataques isquémicos espinales transitorios o por claudicación intermitente de la médula espinal durante el ejercicio (síntomas transitorios de mielopatía) si hay estrechamiento luminal de los vasos espinales generalmente por su pequeño calibre no por ateromatosis, sino por hialinización arterioesclerótica.
- Cuadro brusco: el déficit máximo se alcanza en minutos o en horas.
- Típicamente asocia dolor radicular en el nivel de la lesión.
Síndromes medulares:
- Arteria espinal anterior: variable lógicamente dependiendo del nivel y extensión de la médula infartada.
1. Lesión completa: como hemos dicho la lesión abarcaría los 2/3 anteriores de la médula. Por debajo de la lesión se produciría primero una fase se shock medular de duración variable entre 3 días a 6 semanas en la que se interrumpen todos los reflejos tendinosos y vegetativos de la médula por debajo de la lesión, cursa con parálisis motora bilateral , hipotonía y arreflexia, déficit sensitivo disociado con afectación sensibilidades dolorosa y térmica con propioceptiva, vibratoria y discriminativa conservadas, y alteraciones autonómicas, parálisis atónica de la vejiga (retención urinaria) y del intestino ( atonía gástrica, íleo paralítico) si afecta a niveles dorsales por encima de D4-D9 pérdida transitoria del tono vasomotor con grave hipotensión sistémica que puede agravar la lesión medular, edema en extremidades, si lesión inferior a C8-D12 anhidrosis por debajo de la lesión, por encima de D5 alteración termorregulación con frialdad palidez de extremidades. Posteriormente se desarrolla una fase de actividad refleja incrementada con piramidalismo, hipertonía, reflejos en flexión intensificados, micción y defecación refleja, sudoración, exaltación reflejo pilomotor. Si el inicio no es brusco ni completo o afecta a pocos segmentos medulares, puede no aparecer la fase de shock medular y aparecer piramidalismo desde el inicio.
2. Lesiones incompletas: En lesiones cervicales hay casos descritos con lesión solo de sustancia gris más sensible a hipoxia (típica imagen de “snake-eyes u “ojos de serpiente” en RM): en extremidades superiores se produce parálisis flácida, arrefléxica y atrófica, síndrome de hombre en barril (Berg D, 1998). Si la lesión es más amplia por debajo aparecerá parálisis con piramidalismo. Una lesión pequeña por oclusión de un vaso central surcal pude presentarse como un síndrome de Brown-Séquard, o una pérdida de sensibilidad suspendida dolorosa y térmica a nivel de la lesión.
- Arteria espinal posterior: no produce un síndrome estereotipado, afectación de cordones posteriores por debajo de la lesión típicamente sin déficit motor, aunque también puede producir afectación motora, por estar las fibras motoras colindantes entre ambos territorios y por la variabilidad de irrigación medular.
- Infarto transverso de la médula.
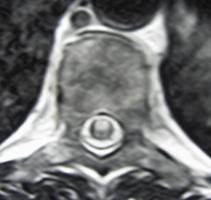
Figura 1. RM médula cervical que muestra en cortes axiales un pequeño infarto anterior.
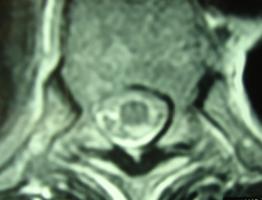
Figura 2. RM médula en cortes trasversales que muestra infarto afectando a los dos tercios anteriores.
DIAGNÓSTICO
El diagnóstico de un paciente con para o tetraplejia de instauración aguda, es una urgencia inmediata pues de ello va a depender el pronóstico y supervivencia.
El primer planteamiento es el diagnóstico topográfico no siempre fácil, fundamentalmente clínico y con pruebas complementarias que se precisen orientadas (Imagen, electromiograma, creatin-fosfoquinasa ó CPK):
- Lesión central: parasagital o medular.
- Periférica: polineuropatía aguda (con disautonomía): Síndrome de Guillain-Barré, porfiria aguda intermitente, diftérica. Enfermedades de la placa: crisis miasténica, botulismo, intoxicación por organofosoforados. Polimiositis y miopatías tóxicas necrosantes.
Una vez confirmada una mielopatía aguda no traumática se plantea su diagnóstico diferencial. Se debe realizar en el menor tiempo posible una RM para descartar etiología compresiva que debe tratarse lo antes posible. Si no hay compresión puede aparecer: hemorragia medular, lesión medular no hemorrágica. Si aparece lesión medular no hemorrágica se debe administrar contraste: si capta apunta a mielitis (recordamos: mucho más frecuentes), si no puede serlo también o vascular, y hay que ampliar estudio con punción lumbar (nunca antes de descartar compresión medular), si aparece pleocitosis nuevamente a punta a mielitis, aunque el que sea normal no la descarta. Si se descarta etiología inflamatoria sospechar isquémica y una vez sospechada isquemia se debe descartar precozmente patología aórtica.
La mayoría de los infartos se pueden identificar en RM, con mayor dificultad los incompletos, apareciendo en secuencias potenciadas en T2 como lesiones hiperintensas lineales en el plano longitudinal vertical en cortes sagitales, como dibujadas con un lapiz, es el patrón “pencil-like”, a veces con ensanchamiento medular y generalmente bilaterales (Stefan Weidauer, 2002) (Ver Figura 3 jpg). Sólo captan gadolinio en escasas ocasiones, más frecuentemente tras varios días de evolución, y la captación es tenue. Si aparece hiperintensidad en T1 indica transformación hemorrágica. El principal problema es que dada la precocidad con que debe hacerse la RM puede ser normal dado que la lesión isquémica no aparece hasta las 2 horas del inicio de los síntomas y puede no visualizarse en las 4 primeras horas, por tanto debería repetirse la RM pasados unos días. La RM con difusión medular sería más precoz en al detección de la isquemia (Thurnher MM, 2006). Como hemos dichos en los casos descritos con lesión solo de sustancia gris más sensible a hipoxia aparece en RM la típica imagen de “snake-eyes” (Ver Figura 4 jpg). Si en la RM se observa infarto cuerpos vertebrales apuntaría a que la lesión medular es también isquémica.
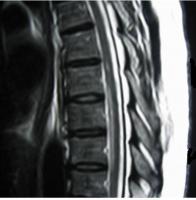
Figura 3. RM médula torácica que muestra un extenso infarto anterior afectando múltiples segmentos medulares (patrón pencli-like).
Figura 4. RM medular de paciente con infarto medular tras anestesia epidural en el que se aprecia ténue alteración de señal en el asta anterior bilateralmente (patrón snake eyes o en ojos de serpiente).
Una vez confirmada el diagnóstico de infarto medular se debe buscar la etiología si no guarda una relación cronológica (recordamos que a veces incluso demorada) con ningún intervencionismo: como hemos dicho, en primer lugar se debe buscar ateromatosis grave e incluso con disección aórtica, fuentes de embolismo sistémicos, y siguiendo la lista de etiologías vasculitis, coagulopatías, y muy importante debe sospecharse siempre la posibilidad de la existencia de una fístula dural lo que requiere la realización de una Arteriografía medular.
BIBLIOGRAFÍA
- Berg D, Mullges W, Klotzenburg M, Bendszus M, Reiners K (1998). Manin-the-barrel syndrome caused by cervical spinal cord infarction. Acta
Neurol Scand 97:417–419.
- Berg P, Kaufmann D, van Marrewijk CD, Buth J (2001). Spinal cord ischemia after stent-graft treatment for infrarenal
abdominal aortic aneurysms. Analysis of the Eurostar data base. Eur J Vasc Endovasc Surg 4:342–347.
- Brouwers PJ, Kottink EJ, Simon MA, Prevo RL (2001). A cervical anterior spinal artery syndrome after diagnostic blockade of the right C6 nerve root. Pain 91:397–399.
- Chan LL, Kumar AJ, Leeds NE, Forman AD (2002). Post-epidural analgesia spinal cord infarction: MRI correlation. Acta Neurol Scand 105: 344-348.
- Cheung AT, Pochettino A, McGarvey ML, et al (2005). Strategies to manage paraplegia risk after endovascular stent repair of descending thoracic aortic aneurysms. Ann Thorac Surg 80:1280–1288.
- David S. Geldmacher, Lubdha ShahContinuum (2008). Vascular Myelopathies. Continuum: Lifelong Learning Neurol 14(3).
- Di Lazzaro V, Restuccia D, Oliveiro A, Profice P, Nardone R, Valeriani M. Colosimo C, Tartaglione T, Della Corte F, Pennini MA, Tonali P (1997). Ischaemic myelopathy associated with cocaine: clinical, neurophysiological and neuroradiological features. J Neurol Neurosurg Psychiatry 63:531–533.
- Hundsberger T, Tho¨mke F, Hopf HC, Fitzek C (1998). Symmetrical infarction of the cervical spinal cord due to spontaneous bilateral vertebral artery dissection. Stroke 29:1742.
- Hong DK, Lawrence HM (2001). Anterior spinal artery syndrome following total hip arthroplasty under epidural anaesthesia. Anaesth Intensive Care 29:62–66.
- Jay J. Han, Teresa L. Massagli, Kenneth M. Jaffe (2004). Fibrocartilaginous Embolism—An Uncommon Cause of Spinal Cord Infarction: A Case Report and Review of the Literature. Arch Phys Med Rehabil 85:153-7.
- Lazorthes G (1972). Pathology, classification and clinical aspects of vascular diseases in spinal cord. In: Vinken PJ, Bruyn GW (eds) Handbook of clinical neurology, vol 12. North-Holland, Amsterdam, pp 492–506.
- Masson C, Pruvo JP, Meder JF, et al (2004). Spinal cord infarction: clinical and magnetic resonance imaging findings and short term outcome. J Neurol Neurosurg Psychiatry 75:1431–1435.
- Michael A. Ludwig, Stephen P. Burns † (2005). Spinal Cord Infarction Following Cervical Transforaminal Epidural Injection. A Case Report.
SPINE 30: 266–268.
- O´ Farrell R, Thornton J, Brennan P, Brett F, Cunningham AJ (2000). Spinal cord infarction and tetraplegia: rare complications of meningococcal meningitis. Br J Anaesth 84:514–517
- Sandson TA, Friedman JH. Spinal cord infarction (1989) . Report of 8 cases and review of the literature. Medicine (Baltimore) 68:282–292.
- Srigley JR, Lambert CD, Bilbao JM, Pritzker KP (1981). Spinal cord infarction secondary to intervertebral disc embolism. Ann Neurol 9:296-301.
- Stefan Weidauer, Michael Nichtweiss, Heinrich Lanfermann, Friedhelm E. Zanella (2002). Spinal cord infarction: MR imaging and clinical features in 16 cases. Neuroradiology 44: 851–857.
- Timo Krings, Pierre L. Lasjaunias, Franz J. Hans, Michael Mull, Robbert J. Nijenhuis, Hortensia Alvarez, Walter H. Backes, Marcus H.T. Reinges, Georges Rodesch, Joachim M. Gilsbach, Armin K. Thron, (2007). Imaging in Spinal Vascular Disease. Neuroimaging Clinics of North America 17: 57-72
- Thurnher MM, Bammer R (2006). Diffusion-weighted MR imaging (DWI) in spinal cord ischemia. Neuroradiology 48:795–801.
- Vijayan N, Peacock HJ (2000). Spinal cord infarction during use of zolmitriptan:a case report. Headache 40:57–60.
- Wildgruber D, Kuntz R, Kermer P, Bartel J, Fetter M, Dichgans J (1999). Elsberg syndrome due to infarction ofthe conus medullaris associated with aprothrombin mutation. J Neurol 246:507–508.
- Woolsey RM, Young RR (1991). Neurologic Clinics: Disorders of the Spinal Cord. Philadelphia, Saunders, 1991.
- 89097 lecturas