Generalidades de la Endocarditis Infecciosa e Ictus
INTRODUCCIÓN:
La endocarditis infecciosa (EI) es la infección del endocardio que causa el crecimiento de vegetaciones en las válvulas cardiacas o el endocardio mural, compuestas de fibrina, bacterias y otras proteínas. La incidencia anual de la EI se ha comunicado entre 1.6 y 4.3 episodios por 100.000 habitantes y causa aproximadamente el 1/1000 de las hospitalizaciones. Son factores predisponentes para EI la enfermedad valvular reumática, malformaciones congénitas cardiacas, enfermedad valvular degenerativa, prolapso mitral, válvulas protésicas, y menos a menudo, los marcapasos y otros aparatos intracardiacos. La EI es además frecuente en pacientes con hemodiálisis y adicción a drogas por vía parenteral (Francioli; 1997).
Las complicaciones neurológicas suponen un problema clínico de gran importancia en las EI por su alta frecuencia y porque a menudo son la primera manifestación clínica o el motivo de consulta inicial de las EI. El neurólogo debe tener en cuenta esta posibilidad diagnóstica ante pacientes con ictus isquémico o hemorrágico, meningitis, absceso cerebral o con cuadro confusional agudo. Además las complicaciones neurológicas incrementan significativamente la mortalidad en pacientes con EI y generan un número importante de pacientes con secuelas neurológicas. Su presencia puede condicionar la indicación y el momento para la cirugía cardiaca, y plantean dificultades en el manejo de la anticoagulación que muchos pacientes con enfermedad cardiaca necesitan.
En el manejo de las complicaciones neurológicas de pacientes con EI se requiere un acercamiento multidisciplinar en el que puede ser necesaria la intervención de cardiólogos, cirujanos cardiacos, neurorradiólogos, neurólogos, neurocirujanos e infectólogos. Existen muchos dilemas de manejo en la práctica clínica habitual en pacientes con EI y complicaciones neurológicas. Por desgracia la evidencia científica disponible para la toma de decisiones es frecuentemente escasa y las recomendaciones habitualmente se basan en series de casos y opiniones de expertos, que a menudo son contradictorias (recomendaciones de clase II y nivel de evidencia B o C). En la mayoría de los casos las decisiones se deben tomar de forma individualizada porque el balance riesgo-beneficio de las diferentes opciones muchas veces varía sustancialmente de un paciente a otro.
TIPOS Y FRECUENCIA DE COMPLICACIONES NEUROLÓGICAS EN LA EI:
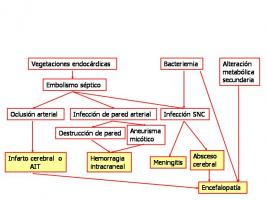
Entre las diferentes complicaciones neurológicas de la EI, las más frecuentes son las cerebrovasculares, que representan entre el 70 y el 80% de todas ellas. Los ictus isquémicos son mucho más frecuentes que los hemorrágicos. Menos comunes son meningitis (1%), absceso cerebral (1-9%) y aneurisma micótico (1-5%). Algunos pacientes sufren un cuadro de encefalopatía difusa, que puede causarse por diferentes mecanismos, como efecto de la sepsis y toxinas bacterianas, presencia de trastornos metabólicos secundarios (hipoxia, fallo renal o hepático), microinfartos múltiples y, raramente, microabscesos múltiples. Otros presentan crisis epilépticas o cefalea sin lesión estructural demostrada. Los datos clínicos, experimentales y patológicos indican que la mayoría de estas complicaciones está causada por embolismos sépticos originados en las vegetaciones cardiacas (ver patogenia de las complicaciones neurológicas de la endocarditis infecciosa. jpg). Estos embolismos producen oclusión arterial causando ataque isquémico transitorio (AIT) o infarto cerebral. Si este embolismo transporta un número suficiente de microorganismos puede producir secundariamente infección y destrucción de la pared arterial provocando hemorragia cerebral o subaracnoidea o aneurisma micótico. En algunos casos estas bacterias pueden producir infección secundaria del sistema nervioso central (SNC) causando meningitis o absceso cerebral. También puede producirse infección del SNC por la bacteriemia constante que ocurre en la EI, lo que explicaría la presencia de estas infecciones en pacientes con endocarditis derecha, sin embolismos al SNC. Es rara la posibilidad de mononeuropatía periférica por embolismo en los vasa nervorum. El que se produzca una u otra complicación dependerá de diversos factores, como el tamaño, localización y la carga bacteriana del émbolo, que a su vez se influye por la virulencia del microorganismo y la presencia o no de tratamiento antibiótico adecuado (Francioli; 1997).
Patogenia de las complicaciones neurológicas de la endocarditis infecciosa.
La frecuencia de complicaciones neurológicas en pacientes con EI se ha comunicado en un amplio rango, entre un 13 y 65% de los casos, según los estudios (Salgado et al; 1989. Hart et al; 1990. Kanter y Hart; 1991. Matsushita et al; 1993. Almirante et al; 1994. Heiro et al; 2000. Corral et al; 2007, Snygg-Martin et al; 2008). Estas diferencias se explican por la ausencia de homogeneidad entre los diferentes estudios (ver tabla: Frecuencia de complicaciones neurológicas en series recientes de endocarditis infecciosa y características de las series). El hecho de que un estudio prospectivo con técnicas de neuroimagen y estudio de líquido cefalorraquídeo (LCR) demuestre que hasta un 65% de pacientes con EI tienen complicaciones cerebrovasculares, demuestra que éstas son muy frecuentes cuando se buscan específicamente (Snygg-Martin et al; 2008). Las comparaciones entre las incidencias comunicadas a lo largo del siglo XX mostraron un a incidencia constante, a pesar de los profundos cambios que hubo en la epidemiología y en el tratamiento de las EI (Francioli;1997. Heiro et al; 2000). En un estudio reciente se ha confirmado una tendencia al aumento de estas complicaciones durante un periodo de 18 años, que se asoció a una disminución de endocarditis derechas por abuso de drogas y a un aumento de las endocarditis nosocomiales y de las causadas por estafilococo aureus (Corral et al; 2007).
Tabla. Frecuencia de complicaciones neurológicas en series recientes de endocarditis infecciosa y características de las series]
FACTORES DE RIESGO
Se han investigado diversos factores clínicos, microbiológicos y ecocardiográficos como posibles factores de riesgo para embolismos y complicaciones neurológicas. La mayor parte de los estudios coinciden en que la EI causada por Staphilococus aureus es el principal factor de riesgo (Corral et al; 2007). Las endocarditis izquierdas tienen obviamente más riesgo de embolismo y más incidencia de complicaciones que las derechas. El papel del tamaño de las vegetaciones está controvertido: algunos estudios muestran un aumento de la frecuencia de embolismos en pacientes con vegetaciones demostradas en ecocardiografía y en caso de vegetaciones mayores de 10 mm, aunque no ha sido confirmado en otros estudios (Salgado et al; 1989). Algunos autores han encontrado un aumento de embolismos en pacientes con endocarditis mitral frente a aórtica. Igualmente, la presencia de vegetaciones en la valva anterior de la mitral podría favorecer los fenómenos embólicos. El aumento de la edad de los pacientes no parece condicionar un aumento de las complicaciones neurológicas.
El agente microbiológico causante es un factor importante que determina la frecuencia y tipo de complicación. El S aureus es el microorganismo más frecuentemente asociado a complicaciones neurológicas, con una frecuencia comunicada entre el 33 y 70%, y es el que más frecuentemente produce complicaciones infecciosas (meningitis y abscesos). Otros microorganismos asociados a alta frecuencia de embolismos son S pneumoniae, Enterococci, enterobacteriaceae, anaerobios y hongos (candida y aspergillus sp). Los estreptococos viridans producen embolismos con menor frecuencia. Los estafilococos coagulasa-negativos (S epidermidis y otros) se han considerado siempre menos agresivos, pero, en contraste con la endocarditis prostética causada por ellos, la endocarditis sobre válvula nativa por estafilococos coagulasa-negativos, frecuentemente de adquisición nosocomial, ha demostrado ser una endocarditis agresiva con un alto índice de complicaciones y mal pronóstico (Martín-Davila et al; 2006).
MOMENTO DE APARICIÓN
Las complicaciones neurológicas, fundamentalmente los ictus (que suponen más de dos tercios de los casos), representan el primer síntoma en casi la cuarta parte de los casos de EI. Es más frecuente todavía que sean los síntomas por los que el paciente busca asistencia médica, generalmente en urgencias, aunque frecuentemente haya otros síntomas previos, sobre todo fiebre, que pueden ser la clave para sospechar EI. Así, la mayoría de los ictus y complicaciones neurológicas (60-80% aproximadamente) se presentan en pacientes que no estaban diagnosticados de endocarditis y, por tanto, antes del inicio de un tratamiento antibiótico adecuado Almirante et al;1994. Corral et al; 2007. Heiro et al; 2006. Salgado et al;1989. Snygg-Martin et al; 2008). Los ictus ocurren en su mayoría en los primeros días antes del diagnóstico, pero en algunos casos pueden pasar meses hasta el diagnóstico de EI. Es importante remarcar este hecho para tener siempre en cuenta la EI en pacientes con ictus, sobre todo en candidatos a tratamiento fibrinolítico, pues este tratamiento está contraindicado en casos de EI por el alto riesgo hemorrágico
Tras el diagnóstico de EI, en pacientes con tratamiento antibiótico, el riesgo de ictus decrece. Entre un 25 y un 40% de los ictus ocurren tras el diagnóstico de EI. Generalmente se presentan en los primeros días desde el inicio del tratamiento, generalmente cuando los hemocultivos son todavía positivos. La mediana de aparición de ictus tras inicio de antibióticos es de 4 días, según varias series (Corral et al; 2007. Salgado et al; 1989). En la mayor parte de las series los ictus son raros a partir de 10 días o 2 semanas tras el inicio del tratamiento antibiótico (Snygg-Martin et al; 2008).
Tras completar el tratamiento antibiótico la posibilidad de embolias es muy rara, y en caso de que se produzca, generalmente se explica por otras causas antes que por el episodio de EI antiguo (ateromatosis, fibrilación auricular, nuevo episodio de endocarditis) (Salgado et al; 1989)
ICTUS ISQUÉMICOS
Los embolismos pueden producir tanto AIT como infartos cerebrales de diverso tamaño. No es infrecuente que en un mismo paciente aparezcan ambos. Las manifestaciones clínicas dependerán del tamaño y la localización del émbolo séptico. Los embolismos más frecuentes se producen en el territorio de la arteria cerebral media, más habitualmente en ramas distales, pero no son raros infartos de territorio posterior ni oclusiones arteriales proximales. Como se mencionó antes, algunos casos de encefalopatía sin signos focales en la EI se deben a infartos cerebrales múltiples. En una serie prospectiva reciente, los casos que presentaban encefalopatía aguda tenían lesiones isquémicas múltiples en resonancia magnética o marcadores de daño cerebral en líquido cefalorraquídeo (Snygg-Martin et al; 2008).
Los embolismos recurrentes son frecuentes. Hay un riesgo importante de recurrencia antes del tratamiento antibiótico (Piper et al; 2001). La mayor parte de los estudios muestran que los episodios embólicos recurrentes son raros en pacientes que reciben antibioterapia adecuada. Sin embargo, en un estudio, de 16 pacientes con ictus como presentación clínica, el 31% tuvieron un nuevo episodio tras el diagnóstico (Snygg-Martin et al; 2008).
Como se comentaba arriba, existe controversia acerca de si la detección de vegetaciones en el ecocardiograma influye en el riesgo de embolismos recurrentes. Debe tenerse en cuenta que con ecocardiografía transesofágica se pueden detectar vegetaciones hasta en el 96% de los casos de EI. En un estudio se demostraron vegetaciones grandes persistentes en el 93% de pacientes con embolismos recurrentes y sólo en el 24% de los pacientes con un único episodio (Piper et al; 2001).
La presencia de embolismos recurrentes tras 2 o 3 semanas de tratamiento antibiótico, como evidencia de infección valvular no controlada, se considera indicación de recambio valvular (Baddour et al;2005). Un episodio de embolismo único no se considera indicación (Heiro et al;2000. Salgado et al 1989). Algunos autores indicarían cirugía en pacientes con vegetaciones de más de 10 mm.
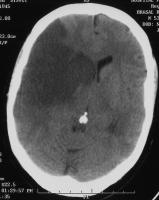
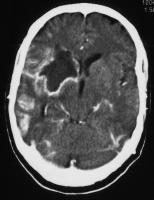
Se ha demostrado la formación de absceso cerebral sobre lesiones previas de embolismo cerebral (ver figuras Absceso cerebral desarrollado en el territorio de un ictus isquémico 1 y 2. jpg).
Absceso cerebral desarrollado en el territorio de un ictus isquémico.
Absceso cerebral desarrollado en el territorio de un ictus isquémico 2.
HEMORRAGIA INTRACRANEAL
La hemorragia intracraneal (HIC) se produce en 3-6% de los casos de EI, y representan hasta el 21% de todas las complicaciones neurológicas. La hemorragia puede ser parenquimatosa o subaracnoidea, y raramente subdural. La HIC es la complicación neurológica más temible de la EI, pues se asocia a una mortalidad muy alta, entre el 35-87% según las series.
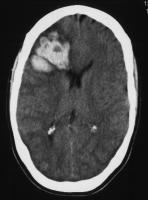
La HIC puede producirse por varios mecanismos: ruptura de un aneurisma micótico, destrucción séptica de la pared arterial (arteritis necrotizante) sin formación de aneurisma, y transformación hemorrágica de un infarto isquémico, fundamentalmente en pacientes anticoagulados. Se ha estimado que cada mecanismo explicaría aproximadamente un tercio de los casos de HIC. Sin embargo, los estudios patológicos en pacientes con HIC demuestran que la transformación hemorrágica de un infarto isquémico es el mecanismo más frecuente de hemorragia intracraneal (56%). La ruptura de una arteritis piógena puede ser la causa de esas hemorragias en muchos casos (Kanter y Hart; 1991). Un aneurisma sólo se demostró en el 20% de los casos (Hart et al; 1987). La ruptura de arteritis piógena puede causar también hemorragia subaracnoidea cuando afecta a ramas distales localizadas en los surcos corticales (Masuda et al;1992) (ver figura Hemorragia subaracnoidea por arteritis piógena en un paciente con endocarditis por estafilococo aureus. jpg). La mayor parte de las HIC por arteritis ocurren en precozmente en el curso de la enfermedad. El episodio hemorrágico puede precederse de AIT en el mismo territorio arterial. En algunos estudios la presencia de HIC precoz o tardía se correlaciona mejor con arteritis piógena e infección por S aureus no controlada (Hart et al; 1987). También puede ocurrir con S epdermidis, estreptococos, otras bacterias y hongos.
Hemorragia subaracnoidea por arteritis piógena en un paciente con endocarditis por estafilococo aureus.
En cuanto a la transformación hemorrágica de los infartos cerebrales, debemos recordar que la sufren de forma espontánea un 10-25% de los infartos cerebrales cardioembólicos en general. El riesgo es mayor en infartos grandes y en pacientes que reciben anticoagulantes. Muchos de los episodios de HIC suceden en pacientes anticoagulados (ver figura Transformación hemorrágica de un infarto isquémico en paciente anticoagulado. jpg). En algunas series clínicas, la mayoría (hasta el 77%) de las HIC sucedían en pacientes previamente anticoagulados, sobre todo aquellos con válvulas protésica (Corral et al; 2007. Pruitt et al; 1978. Delahaye et al;1990).
Transformación hemorrágica de un infarto isquémico en paciente anticoagulado.
ANEURISMA MICÓTICO INTRACRANEAL (AMIC)
La incidencia de AMIC se ha comunicado entre el 1.2 y el 5.4% de los pacientes con EI en series recientes (Francioli; 1997. Pruitt te al; 1978. Salgado et al, 1989). Sin embargo, su incidencia podría estar infravalorada porque algunos podrían permanecer asintomáticos y curar con tratamiento antibiótico. En estudios antiguos, que incluían casos de la era preantibiótica, la incidencia se comunicó en un 10% (Francioli; 1997). También se puede afirmar que la frecuencia de los AMIC depende de la intensidad con la que se busquen. Cuando se ha realizado arteriografía cerebral de forma sistemática en la fase aguda de la EI, se han encontrado cifras de hasta 31% de incidencia. En una serie se encontró AMIC en 11 de 35 pacientes con complicaciones neurológicas (35%) (Sthilhart et al;1986). Se documentan AMIC múltiples hasta en un 20% de los casos, pero su demostración requiere arteriografía de los 4 vasos, que frecuentemente no se realiza.
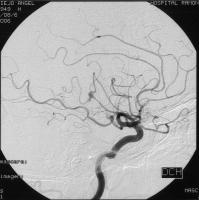
Los AMIC son generalmente pequeños y se localizan en ramas periféricas, distales a la bifurcación de las grandes arterias intracraneales (ver figura Aneurisma micótico.jpg), en contraste con los aneurismas congénitos, que se localizan cerca del polígono de Willis. La mayoría se localizan en ramas terminales de la arteria cerebral media, mientras que otras localizaciones son menos frecuentes. Morfológicamente son saculares o fusiformes. Se producen por embolismos sépticos en los vasa vasorum, o en la luz de los vasos en caso de arterias periféricas, que carecen de vasa vasorum. A menudo se afectan los puntos de bifurcación arterial, probablemente como resultado de la impactación del émbolo en esos lugares. Parece que la presencia de émbolos infectados, y no sólo bacterias circulantes, son necesarios para la formación de los AMIC, ya que son raros en las bacteriemias de la EI derecha. En anatomía patológica se caracterizan por la destrucción de la arquitectura normal de la pared arterial (pseudoaneurisma), con destrucción de la capa muscular y presencia de infiltrados inflamatorios.
Aneurisma micótico.
La presentación clínica característica de los AMIC es como una hemorragia subaracnoidea o intraparenquimatosa, de inicio brusco y a menudo fatal, sin síntomas o signos premonitorios. Muchas hemorragias son la forma de presentación de la EI. La ruptura puede producirse durante el tratamiento antibiótico o tras completarlo. Muchos pacientes, o todos según alguno estudio, pueden tener síntomas neurológicos antes de la ruptura del aneurisma. La cefalea centinela es frecuente, y por tanto cualquier cefalea localizada o intensa en pacientes con EI debe hacer sospechar AMIC. Muchos pacientes (hasta el 50%) tienen historia que indica un embolismo cerebral previo, a veces como AIT (Pruitt et al; 1978. Jones y Siekert; 1988). Así, los pacientes con complicaciones neurológicas pueden tener una incidencia mayor de AMIC, comunicada entre un 5 y un 12%. El intervalo entre el síntoma centinela y la ruptura del aneurisma puede ser de horas, pero normalmente pasan varios días. Los AMIC pueden aparecer incluso tras una primera arteriografía cerebral normal.
La realización de tomografía computarizada (TC) y resonancia magnética (RM) pueden confirmar la hemorragia. Las secuencias T2 en RM son muy útiles para la detección de pequeñas hemorragias (Klein et al; 2007). El estudio de LCR puede ser necesario para demostrar la hemorragia subaracnoidea.
BIBLIOGRAFÍA
Almirante, B, Tornos M P, Pigrau C, Gavaldá A, Pahissa A, Soler-Soler J (1994). Complicaciones neurológicas en la endocarditis infecciosa. Med Clin (Barc). 102:652-656.
Angstwurm K, Borges AC, Halle E, Schielke E, Einhäupl KM, Weber JR. (2004). Timing the valve replacement in infective endocarditis involving the brain. J Neurol. 251: 1220-1226.
Baddour LM, Wilson WR, Bayer AS, Fowler VG, Bolger AF, Levison ME, et al. (2005). Infective endocarditis. Diagnosis, antimicrobial therapy, and management of complications. a statement for healthcare professionals from the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, and the Councils on Clinical Cardiology, Stroke, and Cardiovascular Surgery and Anesthesia, American Heart Association. Circulation. 111;e394-e434.
Bullock R, Van Dellen JR. (1982). Rupture of bacterial intracranial aneurysms following replacement of cardiac valves. Surg Neurol. 17: 9-11.
Corral I, Martín-Dávila P, Fortún J, Navas E, Centella T, Moya JL, et al. (2007) Trends in neurological complications of endocarditis. J Neurol. 254: 1253-1259.
Delahaye JP, Ponce PH, Malquarti V, Beaune J, Gare JP, Mann JM. (1990). Cerebrovascular accidents in infective endocarditis: role of anticoagulation, Eur Heart J. 11: 1074-1078.
Dhomne S, Rao C, Shrivastava M, Sidhartha W, Limaye U. (2008). Endovascular management of ruptured cerebral mycotic aneurysms. Br J Neurosurg. 22: 46-52.
Eishi K, Kawazoe K, Kuriyama Y, et al. (1995). Surgical management of infective endocarditis associates with cerebral complications, J Thorac Cardiovasc Surg. 110: 1745-55.
Francioli PB (1997). Complications of infectious endocarditis. En: Scheld WM, Whitley RJ, Durack DT (eds) Infections of the central nervous system. Lippincott-Raven Publishers, Philadelphia, pp 523-553.
Gillinov AM, Shah RV Curtis WE et al (1996). Valve replacement in patients with endocarditis and acute neurologic deficit, Ann Thorac Surg. 61: 1125-30
Hart RG, Kagan-Hallet K, Joerns SE. (1987). Mechanisms of intracranial hemorrhage in infective endocarditis. Stroke. 18: 1048-1056.
Heiro M, Nikoskelainen J, Engblom E, Kotilainen E, Marttila R, Kotilainen P (2000). Neurologic manifestations of infective endocarditis. A 17-year experience in a teaching hospital in Finland. Arch Intern Med. 160:2781-2787.
Jones HR, Siekert RG (1989). Neurological manifestations of infective endocarditis. Review of clinical and therapeutic challenges. Brain. 112:1295-1315.
Kanter MC, Hart RG (1991). Neurologic complications of infective endocarditis. Neurology. 41:1015-1020.
Klein I, Iung B, Wolff M, Brochet E, Longuet P, Laissy JP, et al (2007). Silent T2 cerebral microbleeds: a potential new imaging clue in infective endocarditis. 68: 2043.
Martín-Dávila P, Fortún J, Navas E, Cobo J, Jiménez-Mena M, Moya JL, Moreno S (2005). Nosocomial endocarditis in a tertiary hospital. An increasing trend in native valve cases. Chest. 128:772-779.
Masuda J, Yutani Ch, Waki R, Ogata J, Kutiyama Y, Yamaguchi T. (1992). Histopathological analysis of the mechanisms of intracerebral hemorrhage complicating infective endocarditis. Stroke. 23: 843-850.
Matsushita K, Kutiyama Y, Sawada T, Yamaguchi T, Nagata S, Kawazoe K, et al (1993). Hemorrhagic and ischemic cerebrovascular complications of active infectious endocarditis of native valve. Eur Neurol. 33; 267-274.
Peters PJ, Harrison T, Lennox JL (2006). A dangerous dilemma: management of infectious intracranial aneurysms complicating endocarditis. Lancet Infect Dis. 6:742-8.
Piper C, Wiemer M, Schulte HD, Horskotte D. (2001). Stroke is not a contraindication for urgent valve replacement in acute infective endocarditis J Heart Valve Dis. 10: 703-711.
Pruitt AA, Rubin RH, Karchmer AW, Duncan GW (1978). Neurologic complications of bacterial endocarditis. Medicine (Baltimore). 57:329-343.
Ruttmann E, Willeit J, Ulmer H, Chevtchik O, Höfer D, Poewe W, Laufer G, Müller LC.(2006). Neurological outcome of septic cardioembolic stroke after infective endocarditis. Stroke. 37:2094-9.
Salgado AV, Furlan AJ, Keys TF, Nichols TR, Beck GF (1989). Neurologic complications of endocarditis: A 12-year experience. Neurology. 39:173-178.
Snygg-Martin U, Gustafsson L, Rosengren L, Alsio A , Ackerholm P, Andersson R, et al. (2008). cerebrovascular complications in patients with left-sided infective endocarditis are common: a prospective study using magnetic resonance imaging and neurochemical brain damage markers. Clin Infect Dis. 47: 23-30.
Stilhart B, Aboulker J, Khouadja F, Robine D, Ouahes O, Redondo A. (1986). Should the aneurysms of Osler disease be investigated and operated on prior to hemorrhage? Neurochirurgie. 32: 410-417.
Ting W, Silverman N, LevtskY S. (1991). Valve replacement in patients with endocarditis and cerebral septic emboli. Ann Thorac Surg. 51: 18-22.
Thuny F, Avierinos JF, Tribouilloy C, et al. (2007). Impact of cerebrovascular complications on mortality and neurologic outcome during infective endocarditis: a prospective multicentre study. Eur Heart J. 28: 1155–61.
- 21629 lecturas