Angioplastia carotídea
INTRODUCCIÓN
El infarto cerebral es la tercera causa principal de mortalidad en EEUU, Canadá, Europa y Japón (Meyers et al., 2010). Las enfermedades ateroscleróticas son la causa de un tercio de dichos infartos, y más de la mitad de éstas estenosis son extracraneales (Gorelick, 2003). La revascularización de la carótida también puede tratar disecciones de la arteria carótida en casos de una amenaza hemodinámica del cerebro. Se han demostrado en ensayos randomizados los beneficios de una endarterectomía de la carótida (CEA) para reducir el riesgo de infarto en pacientes sintomáticos con estenósis carotidea de más del 50% (Barnett et al., 1998) o en pacientes asintomáticos con una estenosis carotidea de más del 60% (Halliday et al.,2004). Sin embargo, en un análisis de los resultados de North American Symptomatic Carotid Endarterectomy Trial (NASCET), la endarterectomía carotidea (CEA) presentó 1,5 veces más complicaciones médicas en pacientes con un historial de infarto de miocardio, angina o hipertensión (Paciaroni et al.,1999). El clampaje temporal de la arteria carótida durante el procedimiento de CEA y la necesidad de anestesia general añaden más riesgos a los riesgos habituales de la naturaleza invasiva de la cirugía. La angioplastia de la arteria carótida con stent (CAS) como técnica mínimamente invasiva evita este tipo de factores de riesgo e igualmente tiene la ventaja de una definición detallada de la lesión durante el periodo preoperatorio, permite la evaluación con imagen de la patología tratada, inmediatamente después del tratamiento y supone una hospitalización más breve (Guimaraens, 2002).
INDICACIONES PARA UNA ANGIOPLASTIA DE LA ARTERIA CARÓTIDA CON STENT
La revascularización de la carótida ya sea vía CEA o CAS, está indicada en pacientes sintomáticos con estenosis de la arteria carótida superior al 50% o en pacientes asintomáticos con una estenosis superior al 70%. Hasta hace unos años, las indicaciones para CAS estaban basadas prácticamente en criterios de exclusión que se utilizaban en ensayos de CEA. La CAS se recomendaba únicamente en aquellos pacientes que no podían tratarse a través de la cirugía debido a factores de riesgo derivados de las condiciones médicas del paciente o por motivos de la anatomía o consideraciones técnicas. En la Tabla 1 (ver tabla 1 jpg) (Biller et al.,1998) se definen las contraindicaciones para una CEA, y como consecuencia de las mismas, las indicaciones claras para realizar la CAS en pacientes con estenosis carotidea. Sin embargo, en muchos centros con una larga tradición de angioplastia de carótida y procedimientos con los stents, CAS sigue utilizándose como el tratamiento más seguro y eficaz para la estenosis carotidéa. Pese a que aún existe el debate, apoyado por estudios bien, y a veces, no tan bien organizados (Mas et al., 2004), sería necesario realizar un ensayo randomizado a gran escala, como CREST o CAVATAS-2 para poder comparar ambas técnicas en pacientes de riesgo normal (Hobson et al., 2004).
FACTORES DE RIESGO PARA UNA INTERVENCIÓN COMPLICADA DE LA ARTERIA CARÓTIDA
Las características anatómicas desfavorables y algunas características de las lesiones son factores que pueden repercutir en los riesgos de la CAS. Las arterias iliacas estenóticas u ocluidas o las lesiones aórticas se encuentran entre las características de acceso desfavorables. La oclusión de la carótida externa o la estenosis que incluye la carótida primitiva puede aumentar el riesgo al colocar el catéter guía. La tortuosidad de la carótida interna, la gravedad de la lesión, el grado de calcificación, la presencia de trombos intraluminales, y una baja ecolucencia de la placa en la ecografía representan otros factores de riesgo.
Además de dichos factores de riesgo, existen una serie de condiciones que pueden crear contraindicaciones para una CAS (Tabla 2) (ver Tabla 2 jpg) (Loh et al.,2007). Un infarto mayor en un periodo inferior a las 4 semanas es una contraindicación relativa. Sin embargo, los infartos agudos debidos a fallos de los colaterales o a una embolización de arteria a arteria podrían ser una excepción a la regla y se podría realizar una CAS para prevenir otros infartos. Pese a que la tortuosidad severa de la arteria carótida podría complicar un caso de CAS para un intervencionista con poca experiencia, hoy en día los últimos catéteres y la técnica de cateterización triaxial puede facilitar una intervención éxitosa. En caso de que el acceso a la arteria carótida derecha fuera muy complejo es posible introducirse a través de una arteria radial o braquial (Theron et al. 2007).
Actualmente existen pruebas de Nivel 1 que indican que pacientes con edad superior a los 80 años tienen un factor de riesgo mayor de sufrir complicaciones post-CAS. Pese a que el análisis del subgrupo NASCET (Alamowitch et al., 2005) indicaba que las mujeres tienen menos beneficios a largo plazo, no existen pruebas de que el género afecte los resultados de CAS.
PROCEDIMIENTO Y CONSIDERACIONES TÉCNICAS
La preparación de los pacientes con una terapia antiplaquetaria y anticoagulante adecuada es esencial para los procedimientos CAS. Los pacientes reciben un régimen doble antiagregante que consistente en aspirina (325 mg. al día) y un derivado de tienopiridinas (clopidogrel 75 mg al día; o ticlopidina – 250 mg dos veces al día) durante al menos tres días antes del tratamiento. No existe consenso sobre el tipo de anestesia que debe utilizarse para procedimientos de CAS. Algunos centros prefieren la anestesia general, y otros prefieren usar una anestesia sedativa para poder evaluar la situación neurológica de los pacientes.
Se realiza con anterioridad un angiograma del arco de la aorta para poder definir las lesiones aterocleróticas así como la configuración anatómica de los troncos supraórticos, que permiten al intervencionista predecir las posibilidades de realizar una cateterización de la carótida y seleccionar los instrumentos necesarios para el procedimiento. Para poder seleccionar el tamaño apropiado del stent, es necesario realizar una arteriografía de la carótida, seguido de una angiografía cerebral preangioplastia a través de la arteria carótida primitiva (CCA). Una dosis intravenosa de heparina (50-60 u/kg) se administra tras la caterización de la CCA. El tiempo de coagulación activada se mantiene entre 250-300 segundos durante el procedimiento. El intervencionista puede intercambiar el catéter de diagnóstico por un introductor largo 6F o por un catéter guía 8F sobre una guía de intercambio. En caso de una anatomía tortuosa podría ser necesario utilizar una cateterización telescópica con sistemas coaxiales.
Los ensayos clínicos SPACE (Ringleb et al., 2006) y ARCHeR (Gray et al.,2006) no muestran ninguna diferencia estadística entre realizar una CAS con un instrumento de protección embólica distal (EPD) o sin él. Algunos centros deciden utilizar o no un EPD dependiendo de su experiencia institucional. Sin embargo la gran mayoría de los centros utilizan los sistemas de protección embolica. Al margen de la opción de EPD, es fundamental haber desplegado el EPD antes de realizar cualquier otra intervención, pero una estenosis muy estrecha podría impedir el paso del instrumento. En este caso una angioplastia con un balón de 2 mm podría permitir un acceso distal. Dado que no hay protección distal, tras la inflación del balón, el catéter guía puede ser aspirado con una jeringa de 20 cc.
El diámetro del stent debe adecuarse al calibre del segmento más ancho de la carótida interna que se va a cubrir. Esto significa que debe ser de 1-2 mm mayor que el diámetro de la arteria carótida primitiva. Los stents más utilizados son de acero inoxidable (Wallstent) o nitinol (Precise, Acculink, X-Act etc.). La ventaja de los stents nitinol es que se adaptan mejor a las curvas de las arterias y éstas no se doblan distalmente. La ventaja de los stents de acero inoxidable es que ofrecen una fuerza radial mayor, lo que permite que la estenosis se dilate más fácilmente. Hay evidencia en la literatura que indica que los stents de diseño de malla cerrada (Wallstent and X-Act) son superiores a los stents de diseño de malla abierta para evitar complicaciones tromboembólicas durante y tras los procedimientos de angioplastia (Jansen et al., 2009, Neumann-Haefelin et al.,2006). Si hay una diferencia de diámetro suficiente entre la CCA y la arteria carótida interna (ICA) es posible utilizar un stent con forma cónica. Si no se ha alcanzado el diámetro apropiado del ICA, tras el despliegue del stent se utiliza otro balón menor de lo normal para expandir el stent. Pero si hubiera una estenosis severa de la ICA con un flujo disminuido distalmente, hay que evitar dilatación post-stent con balón para no aumentar el riesgo de síndrome de hiperperfusión. No se debe inflar el balón múltiples veces para evitar así las complicaciones trombo-embólicas. Por lo general, se aceptan estenosis residuales del 30-40% porque los stents de nitinol auto-explandibles pueden seguir expandiéndose con el tiempo.
Si el stent o el balón no navega distalmente debido a la tortuosidad arterial y a la falta de soporte del sistema del catéter guía, una guía de 0.035 se puede introducir para dar mas soporte al sistema del stent o al del balón (Théron JG et al., 2003). Algunas veces el micro-catéter de balón puede engancharse con las mayas del stent mientras pasa por dentro. Si el intervencionista puede subir el catéter guía hasta dentro del stent es posible empujar el microcatéter del balón más fácilmente. Tras la dilatación post-stent, el EPD se recupera y la intervención se completa. Hay que asegurarse de que el filtro no queda atrapado entre las mayas del stent mientras éste se retira. El procedimiento debe terminarse siempre con una angiografía cerebral de control para descartar cualquier complicación trombo-embólica, disecciones o vasoespasmo severo.
Si no hay ninguna complicación se puede dejar de suministrar la heparina después de realizar una angiografía cerebral de control. Es necesario continuar con la doble antiagregación durante el plazo de 1-6 meses, y después habrá que continuar con antiagregación simple diaria durante un periodo mínimo de un año, siempre que no hubiera alguna contraindicación para dicho medicamento.
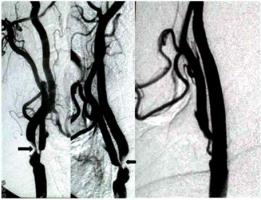
Figura 1A y 1B: Estenosis severa (>90%) en la arteria carótida derecha (Flechas). La arteriografía postangioplastia muestra dilatación completa de la arteria.
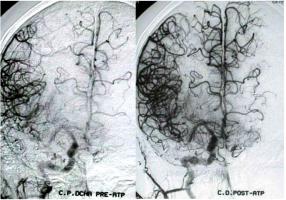
Figura 2A: Angiografía cerebral antes de la angioplastia con stent. Muestra una circulación pobre del hemisferio derecho y la ralentización de las ramas de la arteria cerebral media derecha. El contraste en la arteria carótida interna está casi completamente lavado, mientras que la arteria cerebral media está aún rellenándose.
Figura 2B: La arteriografía postangioplastia muestra una imagen normal de la arteria cerebral media derecha y de la arteria cerebral anterior derecha. La circulación de la arteria cerebral anterior izquierda por la arteria comunicante anterior también es normal. El material de contraste llega a ambos hemisferios antes y dentro de los límites fisiológicos.
COMPLICACIONES
Además de las complicaciones generales de los procedimientos de neuroradiología intervencionista como el hematoma en la zona de la punción, pseudoaneurismas, fístulas arteriovenosas, embolias de aire, etc., existen una serie de complicaciones específicas de CAS (Theron J et al.1998).
La disección de la carótida es un tipo de complicación posible durante los procedimientos de angioplastia con stent. Mientras que para los casos de disecciones que no suponen una amenaza hemodinámica y las disecciones asintomáticas basta con realizar una observación clínica, los casos sintomáticos o las disecciones que causan una estenosis crítica deben tratarse con stent.
Si un paciente desarrollara un cambio neurológico súbito, el intervencionista debe verificar un posible caso de hemorragia o isquemia y debe buscar el origen del problema en la angiografía. En caso de anestesia general, es fundamental llevar a cabo una evaluación detallada de las imágenes angiográficas de control, debido a la falta de evaluación neurológica. Si se diera un caso claro de oclusión de alguna de las arterias se deberá realizar la trombolisis. Si hay flujo lento en las ramas distales o un defecto de flujo en el stent debido a una agregación plaquetaria, se deberán administrar agentes antiplaquetarios IIb/IIIa. Si se observa una hemorragia, se debe revertir heparina con protamina, controlar la presión arterial estrictamente y realizar un TAC craneal. Se debe repetir el TAC entre las 6 y las 12 horas y se pueden evacuar los hematomas severos en pacientes a los que se les puede salvar.
Es posible que el paciente tenga bradicardia durante la angioplastia. En caso de que el paciente tuviera hipotensión o que la bradicardia fuera severa será necesario tener disponible atropina y vasoconstrictores. En ocasiones es preciso recurrir a la colocación de un marcapasos transitorio.
SEGUIMIENTO DESPUÉS DE LA ANGIOPLASTIA
Tras la intervención se debe mantener la presión arterial del paciente dentro de los límites normales. Es preciso evitar la hipotensión y la hipertensión. Debe evaluarse a los pacientes con especial atención para prever un posible síndrome de hiperperfusión. Debe prestarse especial atención a los casos de estenosis severa y oclusión contralateral para evitar hemorragias de reperfusión. Estudios recientes muestran que la leukoaraiosis y las microhemorragias en la resonancia magnética son factores de riesgo para la hemorragia de reperfusión después de una revascularización (14). El seguimiento radiológico incluye una angio-TAC tras 6 meses. En caso de sospecha se puede realizar una arteriografía para descartar restenosis o cualquier otra posible complicación. Hay centros dónde se realizan estudios de ecodoppler para hacer el seguimiento en los pacientes de angioplastia.
BIBLIOGRAFÍA:
• Alamowitch S, Eliasziw M, Barnett HJ, North American Symptomatic Carotid Endarterectomy Trial (NASCET); ASA Trial Group; Carotid Endarterectomy (ACE) Trial Group. The risk and benefit of endarterectomy in women with symptomatic internal carotid artery disease. Stroke 2005;36(1):27–31.
• Barnett HJ, Taylor DW, Eliasziw M, et al. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. North American Symptomatic Carotid Endarterectomy Trial Collaborators. N Engl J Med 1998; 339:1415–1425.
• Biller J, Feinberg WM, Castaldo JE, et al. Guidelines for carotid endarterectomy: a statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Circulation 1998;97(5):501–509
• Carotid angioplasty with cerebral protection and stenting: report of 164 patients (194 carotid percutaneous transluminal angioplasties).
• Gorelick PB. Distribution of atherosclerotic cerebrovascular lesions. Effects of age, race, and sex. Stroke 1993;24(12 Suppl):I16–9.
• Gray WA, Hopkins LN, Yadav S, et al. ARCHeR Trial Collaborators. Protected carotid stenting in high-surgical-risk patients: the ARCHeR results. J Vasc Surg 2006;44(2):258–268.
• Guimaraens L, Sola MT, Matalí A, Arbeláez A, Delgado M, Soler L, Balaguer E, Castellanos C, Ibáñez J, Miquel L, Theron J.Cerebrovasc Dis. 2002;13(2):114-9.
• Halliday A, Mansfield A, Marro J, et al. Prevention of disabling and fatal strokes by successful carotid endarterectomy in patients without recent neurological symptoms: Randomised controlled trial. Lancet 2004; 363:1491–1502.
• Hobson RW 2nd, Howard VJ, Roubin GS, et al. CREST Investigators. Carotid artery stenting is associated with increased complications in octogenarians: 30-day stroke and death rates in the CREST lead-in phase. J Vasc Surg 2004;40(6):1106–1111.
• Jansen O, Fiehler J, Hartmann M, Brückmann H. Protection or nonprotection in carotid stent angioplasty: the influence of interventional techniques on outcome data from the SPACE Trial. Stroke. 2009 Mar;40(3):841-846.
• Loh Y., Duckwiler G.D. Extracranial Stenosis: Endovascular Treatment, Neuroimag Clin N Am 17 (2007) 325–336.
• Mas JL, Chatellier G, Beyssen B. Carotid angioplasty and stenting with and without cerebral protection: clinical alert from the Endarterectomy Versus Angioplasty in Patients With Symptomatic Severe Carotid Stenosis (EVA-3S) trial. The EVA-3S Investigators. Stroke 2004 35:e18–e21.
• Neumann-Haefelin T, Hoelig S, Berkefeld J, Fiehler J, Gass A, Humpich M,Stroke. 2006;37:2463-2466
• Paciaroni M, Eliasziw M, Kappelle LJ, et al. Medical complications associated with carotid endarterectomy. North American Symptomatic Carotid Endarterectomy Trial (NASCET). Stroke 1999; 30(9):1759–1763.
• Ringleb PA, Allenberg J, Bruckmann H, et al. SPACE Collaborative Group. 30 day results from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial. Lancet 2006; 368(9543):1239–47.
• Théron J, Guimaraens L, Casasco A, Sola T, Saleme S, Courtheoux P, Hamon M. Radial approach in the treatment of supraaortic arterial lesions. Interv Neuroradiol. 2007 Jun;13(2):133-44. Epub 2007 Sep 13.
• Theron J, Guimaraens L, Coskun O, Sola T, Martin JB, Rufenacht DA. Complications of carotid angioplasty and stenting. Neurosurg Focus. 1998 Dec 15;5(6):e4
• Théron J, Guimaraens LJ, Casasco AE, Courtheoux PG, Beaujeux RL, Rufenacht DA, Coskun O, Sola MT, Constans JM, Martin JB. "Protected" wallstenting of atheromatous stenoses at the carotid bifurcation. Interv Neuroradiol. 2003 Jun 30;9(2):99-126.
• Writing Group for the American Academy of Neurology, AANS/CNS erebrovascular Section, Society of NeuroInterventional Surgery, and the Society of Vascular & Interventional Neurology, P.M. Meyers, H.C. Schumacher, M.J. Alexander, C.P. Derdeyn, A.J. Furlan, R.T. Higashida, Performance and Training Standards for Endovascular Ischemic Stroke Treatment, AJNR Am J Neuroradiol 2010 31:E8–E11
- 28219 lecturas