RESUMEN
Los astrocitomas difusos (AD) son los gliomas de bajo grado más frecuentes. Afectan sobre todo a niños y adultos jóvenes entre 20 y 40 años. Se clasifican como tumores de grado II de la OMS. Se describen 3 subtipos histológicos: astrocitoma fibrilar, protoplásmico y gemistocítico. Las anomalías genéticas más frecuentes son las mutaciones de TP53 y de la isocitrato dehidrogenasa 1 (IDH1). Aunque habitualmente se describen como tumores indolentes o “benignos”, los AD son en realidad neoplasias malignas que limitan la tasa de supervivencia a 10 años a un 17%, siendo la mediana de supervivencia de 4,7 años. Se han descrito múltiples variables pronósticas, entre las que destacan la edad y situación funcional del paciente, la existencia de déficit neurológico, el tamaño del tumor, y su localización en áreas elocuentes.
Su síntoma de presentación más frecuente son las crisis epilépticas. Se presentan generalmente como lesiones difusas infiltrativas de localización hemisférica en sustancia blanca, pero pueden aparecer como lesiones focales circunscritas. Pueden afectar al córtex adyacente, y tienen especial predilección por áreas funcionales “secundarias” como el área suplementaria motora y el lóbulo de la ínsula. La captación de contraste es poco frecuente, y su aparición debe hacer sospechar malignización.
Las opciones terapéuticas en los AD son: observación, cirugía, radioterapia y quimioterapia. La observación estricta, con controles radiológicos periódicos, se recomienda en pacientes asintomáticos o mínimamente sintomáticos, e incluso en aquellos con crisis epilépticas al diagnóstico, pero bien controladas con tratamiento médico. La observación está contraindicada en aquellos pacientes cuya sintomatología no se controla con tratamiento médico. La cirugía permite la obtención de histología para llegar al diagnóstico definitivo y caracterización molecular del tumor, y es la primera opción terapéutica en la mayoría de los casos. Sin embargo, aun en el caso de conseguirse una resección macroscópicamente completa, debe mantenerse un estrecho control, dado que, en pacientes <40 años intervenidos de astrocitomas de bajo grado no pilocíticos, se ha evidenciado una tasa de progresión tumoral de más del 50% a los 5 años. El momento óptimo para iniciar la radioterapia y las dosis más adecuadas para el tratamiento de los AD aún son objeto de discusión. En general, la radioterapia puede diferirse en pacientes en buena situación clínica, siempre que se haga un seguimiento cuidadoso. Los pacientes mayores de 40 años, los pacientes con tumores grandes irresecables y los que presentan déficit neurológico, son habitualmente tratados con radioterapia precoz. En cuanto al uso de quimioterapia, aunque no se dispone de evidencia firme para su uso adyuvante postquirúrgico (se ha observado beneficio en la supervivencia libre de progresión, pero no en la supervivencia global), hay ensayos clínicos prospectivos en marcha para evaluar esta indicación. En el momento de la progresión puede estar indicado el tratamiento quimioterápico o la reirradiación.
INTRODUCCIÓN
Los astrocitomas difusos (AD) son los gliomas de bajo grado más frecuentes (Davis et al: 2001). Clasificados como gliomas grado II de la OMS (Louis et al; 2007), afectan sobre todo a niños y adultos jóvenes entre 20 y 40 años, aunque en estudios recientes se ha observado un aumento progresivo de su incidencia en pacientes mayores de 60 años (Pouratian et al; 2008).
MANIFESTACIONES CLÍNICAS
El síntoma de presentación más frecuente son las crisis epilépticas (65-95%), aunque, dado que se trata de tumores de crecimiento lento, con frecuencia los síntomas aparecen de forma insidiosa en forma de cefaleas (40%), cambios de conducta (10%), depresión, etc., y pueden prolongarse varios años antes del diagnóstico (De Angelis; 2001).
NEUROIMAGEN
Los AD se presentan generalmente como lesiones difusas infiltrativas, pero pueden aparecer como lesiones focales circunscritas. Son tumores de localización hemisférica en sustancia blanca que pueden afectar al córtex adyacente, y que tienen especial predilección por áreas funcionales “secundarias” como el área suplementaria motora y el lóbulo de la ínsula (Ruiz et al; 2010). En RM son lesiones iso o hipointensas en T1, homogéneamente hiperintensas en T2, en las que la aparición de edema, hemorragia y captación de contraste son poco frecuentes [Astrocitoma difuso.jpg].

Se pueden observar calcificaciones en TC en el 15-20% de los casos. Puede afectar al córtex y producir erosión del díploe, indicando un crecimiento lento. En su extensión por los tractos de sustancia blanca puede condicionar crecimiento del hemisferio afecto, pasando a ser una forma de gliomatosis cerebri secundaria [Link a 3.2.4.1.3.Gliomatosis cerebri]. Puede ser indistinguible de una lesión de sustancia blanca no neoplásica. En aquellos casos en los que aparezcan focos de captación de contraste o de restricción de difusión se debe sospechar una degeneración maligna (Scarabino et al; 2005).
HISTOPATOLOGÍA Y BIOLOGÍA MOLECULAR
En la clasificación histopatológica de la OMS actualizada en 2007 se diferencian 3 subtipos histológicos:
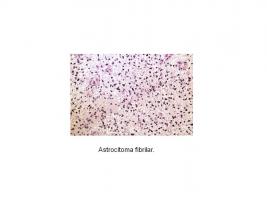
- Astrocitoma fibrilar: Se observan fundamentalmente en los hemisferios cerebrales. Son tumores sólidos, pero pueden tener degeneración microquística. Habitualmente son hipercelulares y presentan atipia nuclear. Infiltran la sustancia blanca y pueden producir satelitosis cuando los astrocitos rodean a las neuronas [Histopatología astrocitoma fibrilar.jpg].
- Astrocitoma protoplásmico: Son tumores de la corteza cerebral, preferentemente frontotemporales. Presentan degeneración quística y degeneración mucoide.
- Astrocitoma gemistocítico: Presentan astrocitos gemistocíticos en más de un 20%. Éstos tienen un aspecto hinchado, con citoplasma eosinófilo. Suele haber linfocitos perivasculares. Son los que con mayor frecuencia progresan hacia astrocitomas de alto grado.
Entre las características moleculares de los AD la anomalía genética más común es la alteración de TP53 (> 59%). Como resultado de la interrupción de la cascada de las vías de transducción de señales y proliferación celular, la división celular anormal facilita la inestabilidad genómica y la transformación anaplásica. Es importante resaltar también el reciente hallazgo de la presencia de mutaciones de la isocitrato dehidrogenasa 1 (IDH1) entre el 59 y el 90% de los AD, mutación descrita como evento temprano en la tumorogénesis (Yan et al; 2009).
PRONÓSTICO
Aunque habitualmente se describen como tumores indolentes o “benignos”, los AD son neoplasias malignas que limitan la tasa de supervivencia a 10 años a un 17%, siendo la mediana de supervivencia de 4,7 años (Shaw et al; 1997).
Se han descrito múltiples variables pronósticas en pacientes con gliomas de bajo grado. Lote et al. (Lote et al; 1997) publicaron un análisis retrospectivo univariante de 373 pacientes con diagnóstico de glioma de bajo grado en el que identificaron como factores pronósticos positivos una edad <20 años, un buen performance status (PS), la ausencia de déficit neurológicos y la ausencia de captación de contraste en estudios de imagen, aunque estudios prospectivos no han confirmado la importancia pronóstica de este último factor (Shaw et al; 2008). A fin de conseguir datos más robustos, la European Organization for Research and Treatment of Cancer (EORTC) analizó de forma conjunta las bases de datos de dos ensayos clínicos (22844/22845). Se aplicó el análisis de Cox a 332 pacientes del Ensayo 22844 y los resultados fueron validados en 288 pacientes del Ensayo 22845. Los pacientes con astrocitomas pilocíticos fueron excluidos. El análisis multivariante mostró que la edad ≥ 40 años, la histología de astrocitoma, el diámetro máximo del tumor ≥ 6 cm, los tumores que cruzan la línea media y la presencia de déficit neurológico antes de la cirugía eran factores desfavorables para la supervivencia. Con estos datos establecieron un modelo pronóstico según el cual, las curvas de supervivencia global se separaban de acuerdo con el número de factores desfavorables presentes en cada paciente. Al agrupar los pacientes en dos grandes grupos, de bajo y alto riesgo, las medianas de SG resultantes en el grupo de validación fueron 7,8 y 3,67 años, respectivamente (Pignatti et al; 2002). Más recientemente, una revisión retrospectiva de 281 pacientes con glioma de bajo grado identificó 4 factores asociados con una menor supervivencia: localización tumoral en área elocuente, KPS≤80, edad >50 años y diámetro tumoral > 4 cm (Chang EF et al; 2008). Este último es el primer sistema pronóstico que considera la localización tumoral en un área elocuente como factor independiente de mal pronóstico.
Varios marcadores moleculares han sido estudiados como factores pronóstico en los gliomas de bajo grado. En AD tan solo un bajo índice de proliferación (marcado por una baja expresión de ki67) y la pérdida de heterocigosidad en los cromosomas 1p y 19q (LOH 1p19q, solo presente en 7% de los AD) se han relacionado con un mejor pronóstico (Torp et al; 2002, Ohgaki; 2005). La presencia de metilación en el promotor del gen de la O6-metilguanin DNA metil-transferasa (MGMT) ha demostrado ser un factor predictivo de respuesta al tratamiento con temozolomida (Everhard et al; 2006).
TRATAMIENTO INICIAL
Las opciones terapéuticas que se plantean en los AD son: observación, cirugía, radioterapia y tratamiento quimioterápico.
Observación.
La observación estricta, con controles radiológicos (RM) cada 3 meses el primer año y posteriormente cada 6 meses en años sucesivos, se recomienda en aquellos pacientes asintomáticos o mínimamente sintomáticos, e incluso en aquellos con crisis epilépticas al diagnóstico pero bien controladas con tratamiento médico (Recht et al; 1992). Esta opción terapéutica está contraindicada en aquellos pacientes cuya sintomatología no se controla con tratamiento médico.
Cirugía.
El papel de la cirugía en los AD es dual: permite la obtención de histología para llegar al diagnóstico definitivo y caracterización molecular del tumor, y es la primera opción terapéutica en la mayoría de los casos. Estudios retrospectivos han demostrado que la extensión de la resección quirúrgica está relacionada con la supervivencia de los pacientes con AD (Sanai et al; 2008), y en estudios multivariantes la resección macroscópicamente completa aparece como el factor pronóstico más importante (Smith et al; 2008). Pese a la resección total debe mantenerse un estrecho control de imagen dado que, en pacientes <40 años intervenidos de astrocitomas de bajo grado no pilocíticos, se ha evidenciado una tasa de progresión tumoral de más del 50% a los 5 años (Shaw et al; 2008).
Radioterapia (RT).
Dentro del abordaje multidisciplinar necesario en el tratamiento de los gliomas de bajo grado las radiaciones ionizantes tienen un papel fundamental. El momento óptimo para iniciar la RT y las dosis más adecuadas para el tratamiento de los AD aún son objeto de discusión. En el estudio de la EORTC 22845 se analizaron 314 pacientes con glioma de bajo grado (astrocitoma, oligodendroglioma, oligoastrocitoma y astrocitoma pilocítico con resección incompleta) y PS 0-2. Los pacientes fueron aleatorizados a recibir RT precoz (54 Gy) u observación. La supervivencia libre de progresión fue de 5,3 años frente a 3,4 años, respectivamente (p<0,0001); sin embargo, no hubo diferencia significativa en la supervivencia global (7,4 y 7,2 años, respectivamente). La conclusión de los autores es que la RT puede diferirse en los pacientes con glioma de bajo grado en buena situación clínica, siempre que se haga un seguimiento cuidadoso (Van den Bent et al; 2005). En la práctica, los pacientes mayores de 40 años, los pacientes con tumores grandes irresecables y los que presentan déficit neurológico, son habitualmente tratados con RT precoz. Aunque en el estudio mencionado no se efectuó un análisis de la calidad de vida, es asumible que el retraso en la RT retrasa también la toxicidad neurocognitiva producida por la misma. Además, el 35% de los pacientes de la rama control no precisaron RT, con un seguimiento de 7,8 años (Baumert et al; 2008). En cuanto a la dosis recomendada, no se han demostrado diferencias estadísticamente significativas para la supervivencia en 2 ensayos multicéntricos randomizados en los que se comparaban dosis altas versus dosis bajas de RT (Karim et al; 1996, Shaw et al; 2002) En la práctica habitual la mayoría de los oncólogos radioterapeutas administran una dosis entre 45 y 54 Gy a 1.8 – 2 Gy/sesión, 5 sesiones/semana.
Quimioterapia.
En los últimos años se han efectuado varios estudios para explorar el papel de la quimioterapia en los gliomas de bajo grado, pero existen pocos ensayos prospectivos que se hayan completado hasta el momento. Aún no disponemos de una evidencia firme sobre el beneficio de la quimioterapia post-quirúrgica, en monoterapia o en combinación con RT en pacientes con AD, ni tenemos datos sobre el momento más adecuado para el tratamiento con quimioterapia en estos pacientes. En el estudio randomizado publicado por el Southwest Oncology Group, en el cual se incluyeron 60 pacientes con diagnóstico de glioma de bajo grado con resección quirúrgica subtotal que fueron randomizados a recibir RT externa versus RT + CCNU, se objetivó una tendencia hacia una mejor supervivencia en el brazo de terapia combinada, sin diferencias estadísticamente significativas (Eyre et al; 1993). El ensayo clínico randomizado con mayor numero de pacientes realizado para valorar el papel de la quimioterapia en estos pacientes es el RTOG 9802. En dicho estudio los pacientes de alto riesgo fueron tratados con RT +/- quimioterapia posterior (6 ciclos de PCV: Procarbazina, CCNU y Vincristina), y se objetivo un beneficio estadísticamente significativo para el brazo de terapia combinada en cuanto a supervivencia libre de progresión, pero no en cuanto a supervivencia global (Shaw et al; 2008).
La temozolomida (TMZ) se ha evaluado como otra posible opción terapéutica adyuvante a la cirugía en pacientes con resección incompleta. En el estudio de Brada et al. el tratamiento con TMZ administrada en pauta convencional (200 mg/m2/día x 5 días cada 28 días), hasta un máximo de 12 ciclos o progresión, obtuvo un 10% de respuestas parciales, un 48% de respuestas menores y un 38% de estabilizaciones (Brada et al; 2003). El 96% de pacientes con déficit en su calidad de vida mejoró, y en el 56% de pacientes con crisis epilépticas, se observó mejoría o desaparición de las mismas. Las respuestas se observaron en todas las histologías, pero el estudio no tenía la potencia estadística necesaria para evaluar la eficacia del tratamiento en cada grupo por separado (n=30). La quimioterapia, por tanto, podría permitir el retraso de la RT y, con ello, sus efectos secundarios, lo que es especialmente importante en pacientes jóvenes. Actualmente hay varios ensayos clínicos en marcha cuyo objetivo es comparar la eficacia de la radioterapia mas TMZ concomitante (RTOG 0424) o de la RT versus TMZ en monoterapia (EORTC 22033).
TRATAMIENTO DE LA PROGRESIÓN
El tratamiento quimioterápico con TMZ ha demostrado ser eficaz en el momento de la progresión, tanto en monoterapia a dosis convencionales (Pace et al; 2003, Quinn et al; 2003), o a dosis extendidas en pacientes previamente radiados o tratados con otros esquemas de quimioterapia (PCV) (Tosoni et al; 2008), como en pacientes sin RT previa (Pouratian et al; 2007). En pacientes pediátricos multitratados se ha utilizado irinotecan y bevacizumab con resultados muy positivos (Packer et al; 2009). La reirradiación es posible en pacientes seleccionados (Combs et al; 2008).
BIBLIOGRAFÍA
Baumert BG, Stupp R; European Organization for Research and Treatment of Cancer (EORTC) Radiation Oncology Group; European Organization for Research and Treatment of Cancer (EORTC) Brain Tumor Group. (2008). Low-grade glioma: a challenge in therapeutic options: the role of radiotherapy. Ann Oncol. 19 Suppl 7:vii217-22.
Brada M, Viviers L, Abson C et al. (2003). Phase II study of primary temozolomide chemotherapy in patients with WHO grade II gliomas. Ann Oncol. 14:1715-21.
Combs SE, Bischof M, Welzel T et al. (2008). Radiochemotherapy with temozolomide as re-irradiation using high precision fractionated stereotactic radiotherapy (FSRT) in patients with recurrent gliomas. J Neurooncol. 89:205-210.
Chang EF, Smith JS, Chang SM, et al. (2008). Preoperative prognostic classification system for hemispheric low-grade gliomas in adults. J neurosurg. 109: 817-824.
Davis FG, Kupelian V, Freels S, McCarthy B, Surawicz T. (2001). Prevalence estimates for primary brain tumors in the United States by behavior and major histology groups. Neuro Oncol. 3: 152-8.
DeAngelis LM. (2001). Brain tumors. N Engl J Med. 344: 114-123.
Everhard S, Kaloshi G, Criniere E, et al. (2006). MGMT methylation : a marker of response to temozolomide in low-grade gliomas. Ann Neurol. 60: 740-743.
Eyre HJ, Crowley JJ, Townsend JJ, et al. a randomized trial of radiotherapy versus radiotherapy plus CCNU for incompletely resected low-grade gliomas: a Southwest Oncology Group study. (1993). J neurosurg. 78: 909-914.
Karim AB, Maat B, Hatlevoll R, et al. a randomized trial on dose-response in radioation therapy of low-grade cerebral glioma: European Organization for Research and Treatment of Cancer (EORTC) Study 22844. (1996). Int J Radiat Oncol Biol Phys. 36: 549-556.
Lote K, Egeland T, Hager B, et al. (1997). Survival, prognostic factors, and therapeutic efficacy in low-grade glioma: a retrospective study in 379 patients. J Clin Oncol. 15:3129-3140.Louis D, Ohgaki H, Wiestler O, et al. (2007). The 2007 WHO Classification of Tumours of the Central Nervous System. Acta Neuropathol. 114:97-109.
Ohgaki H. (2005).Genetic pathways to glioblastomas. Neuropatology. 25: 1-7.
Pace A, Vidiri A, Galiè E, Carosi M, Telera S et al. (2003). Temozolomide chemotherapy for progressive low-grade glioma: clinical benefits and radiological response. Ann Oncol. 14:1722-1726.
Packer RJ, Jakacki R, Horn M, Rood B, Vezina G et al. (2009). Objective response of multiply recurrent low-grade gliomas to bevacizumab and irinotecan. Pediatr Blood Cancer. 52: 791-795.
Pignatti F, van den Bent M, Curran D et al. (2002). Prognostic factors for survival in adult patients with cerebral low-grade glioma. J Clin Oncol. 20: 2076-84.
Pouratian N, Gasco J, Sherman JH, Shaffrey ME, Schiff D. (2007). Toxicity and efficacy of protracted low dose temozolomide for the treatment of low grade gliomas. J Neurooncol. 82: 281-288.
Pouratian N, Mut M, Jahannathan J, Lopes MB, Shefrey ME, Schiff D. (2008). Low-grade gliomas in older patients: a restrospective analysis of prognostic factors. J Neurooncol. 90: 341-350.
Quinn JA, Reardon DA, friedman AH, et al. (2003). Phase II trial of temozolomide in patients with progressive low-grade glioma. J clin Oncol. 21: 646-651.
Recht LD, Lew R, Smith TW. (1992). Suspected low-grade glioma: is deferring treatment safe? Ann Neurol. 31:431-436.
Ruiz J, Lesser GJ. (2010). Low-grade gliomas. Curr Treat Options Oncol. 10: 231-242.
Sanai N, Berger MS. (2008). Glioma extent of resection and its impact in patient outcome. Neurosurgery. 62: 753-764.
Scarabino T, Giannatempo GM, Nemore F, Popolizio T, Stranieri A. (2005). Supratentorial low-grade gliomas. Neuroradiology. J Neurosurg Sci. 49: 73-6.
Shaw EG, Scheithauer BW, O’Fallon JR. (1997). Supratentorial gliomas: a comparative study by grade and histologic type. J Neurooncol. 31: 273-278.
Shaw E, Arusell R, Scheithauer B, O'Fallon J, O'Neill B et al. (2002). Prospective randomized trial of low- versus high-dose radiation therapy in adults with supratentorial low-grade glioma: initial report of a North Central Cancer Treatment Group/Radiation Therapy Oncology Group/Eastern Cooperative Oncology Group study. J Clin Oncol. 20:2267-2276.
Shaw EG, Wang M, Coons S, et al. (2008). Final report of Radiation Therapy Oncology Group (RTOG) protocol 9802: radiation therapy (RT) versus RT + procarbazine, CCNU, and vincristine (PCV) chemotherapy for adult low-grade glioma (LGG). J Clin Oncol. 26: 2008 (May 20 suppl; abstr 2006).
Shaw E, Berkey B, Coons S, et al. (2008). Recurrence following neurosurgeon-determined gross total resection of adult supratentorial low-grade glioma: results of a prospective clinical trial. J Neurosurg. 109: 835-841.
Smith JS, Chang EF, Lamborn KR, et al. (2008). Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol. 26: 1338-1345.
Torp SH, alsaker M. (2002). Ki-67 immunoreactivity, basic fibroblastic growth factor (bFGF) expression, and microvessel density as supplementary prognostic tools in low-grade astrocitomas. An immunohistochemichal study with spetial reference to the reliability of different ki-67 antibodies. Pathol Res Pract. 198: 261-265.
Tosoni A, Franceschi E, Ermani M, Bertorelle R, Bonaldi L, Blatt V, Brandes AA. (2008). Temozolomide three weeks on and one week off as first line therapy for patients with recurrent or progressive low grade gliomas. J Neurooncol. 89: 179-185.
Van den Bent MJ, Afra D, De witte O, et al. (2005). Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet. 366:985-990.Yan H, Parsons DW, Jin G, et al. (2009). IDH1 and IDH2 mutations in gliomas. N Engl J Med. 360: 765-773.