Diagnóstico y tratamiento de las trombofilias hereditarias
MANIFESTACIONES CLÍNICAS
Se ha intentado relacionar las trombofilias con diferentes tipos de ictus isquémicos de arteria de pequeño o gran tamaño, pero no se ha podido establecer esta relación. (Jungehulsing, 2008). Los síntomas y signos dependerán de la localización de la arteria afectada. En el caso de las trombosis de senos venosos tampoco ha podido establecerse un patrón típico de enfermedad.
DIAGNÓSTICO
Las recomendaciones para el diagnóstico y tratamiento de los pacientes con sospecha de trombofilia como causa de un ictus isquémico son controvertidas. De hecho, hay autores que sugieren únicamente la realización de un estudio de anticuerpos antifosfolípido (ver diagnóstico de síndrome antifosfolípido) en pacientes con sospecha de coagulopatía tanto si es hereditaria como adquirida (Jungehulsing GJ, 2008), obviando las trombofilias hereditarias, dado el elevado coste de estas pruebas si se realizan de forma rutinaria en pacientes con ictus.
La Sociedad Española de Neurología (Álvarez Sabin J, 2006) recomienda la realización del estudio de trombofilias con análisis seleccionados y en orden secuencial según los hallazgos (Ver Tabla 1 jpg. Tabla de pruebas hematológicas de diagnóstico) a pacientes con ictus que sean:
• Menores de 50 años,
• Sin causa manifiesta de enfermedad tromboembólica, o
• Si hay datos en la historia previa que sugieran trombofilia (trombosis de repetición en localizaciones inusuales, infartos cerebrales múltiples sin causa conocida, historia familiar de trombosis, sospecha de síndrome antifosfolípido, sospecha de déficit de proteína C o S o de antitrombina III).
Tabla 1. Tabla de pruebas hematológicas de diagnóstico
Además, hay que tener en cuenta que no todos los estudios de trombofilias son iguales y que hay que escoger el momento adecuado para su determinación. Las recomendaciones son:
1. Obtener los análisis al menos 6-8 semanas después del estado trombótico activo especialmente en las mutaciones de AT, PC y PS
2. Evitar la administración de anticoagulantes al menos las 2 semanas previas a la determinación, sobre todo en los déficit de PC y PS por ser vitamina-K dependientes
3. Confirmar las determinaciones si salen patológicas semanas o meses después (excepto para la mutación G20210A).
4. Valorar el estudio de otros miembros de la familia.
En el caso de la hiperhomocistinemia se recomienda el análisis de la homocisteína basal y tras una carga de metionina, pero no se ha establecido un específico momento para la realización de este test. Un nivel normal de homocisteína en ayunas no implica necesariamente un metabolismo normal de homocisteína en pacientes jóvenes con ictus isquémicos.
TRATAMIENTO
El tratamiento óptimo de un paciente con una coagulopatía después de un ictus isquémico es desconocido.
No hay estudios randomizados que comparen la anticoagulación a largo plazo con la terapia antiagregante o el placebo en los pacientes con trastornos de la coagulación y en consecuencia, se desconoce el verdadero grado de reducción del riesgo con una terapia específica.
La prevención secundaria con warfarina indefinida está indicada en pacientes considerados de riesgo (Bauer KA, 2010). En este grupo se incluyen aquellos casos de ictus isquémico con una coagulopatía bien documentada. (Bauer KA, 2001).
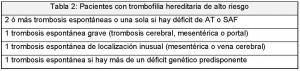
Tabla 2. Pacientes con trombofilia hereditaria de alto riesgo.
Algunos pacientes con déficit de antitrombina son resistentes a la heparina y requieren dosis mayores. Existe un concentrado de AT preparado con muestras de plasma humano que puede administrarse como terapia coadyuvante en situaciones graves.
En la homocistinemia, el déficit vitamínico debe compensarse con un tratamiento adecuado y evaluar repetidamente la homocisteína en suero. Se necesitan estudios prospectivos basados en el tratamiento con vitamina B12 y folato para determinar la reducción del riesgo de ictus en prevención primaria y secundaria. Así como delimitar el riesgo de estos pacientes a sufrir un ictus pues los datos basados en los niveles de homocisteína siguen siendo contradictorios
Estas medidas deben asociarse al resto de las recomendaciones para el paciente con ictus: prevención de factores de riesgo cerebrovascular, realización de ejercicio de forma regular…
Un aspecto importante es el tratamiento en situaciones que pueden favorecer los estados protrombóticos: embarazo, cirugías… en el caso de pacientes portadores de estas trombofilias, la recomendación es considerarles como pacientes de alto riesgo para el desarrollo de fenómenos trombóticos y administrar heparinas de bajo peso molecular pre y post-cirugía.
BIBLIOGRAFÍA
Álvarez Sabin J, Rovira Cañellas A, Molina C, Serena J, Moltó JM (2006). Guía para la utilización de métodos y técnicas diagnósticas en el ictus. En: Díez Tejedor E (Ed), Guía para el diagnóstico y tratamiento del ictus (pp 25-63). Barcelona: Prous Science.
Bauer KA. (2001). The thrombophilias: well-defined risk factors with uncertain therapeutic implications. Ann Intern Med. 135: 367.
Bauer KA. Management of inherited thrombophilia. Acceso el 13 de julio de 2010. http://www.uptodate.com/online/content/thrombophilia.
Bushnell CD, Goldstein LB (2002). Physician knowledge and practices in the evaluation of coagulopathies in stroke patients. Stroke. 33: 948-953.
Cervera R, Boffa M-C, Khamastha MA, Hughes GRU. (2009). The Euro-Phospholipid project epidemiology of the antiphospholipid syndrome in Europe. Lupus. 18: 889-93.
Conde A, Aristin J, Gómez JC. (2010). Ictus, lupus eritematoso sistémico y síndrome antifosfolípido. Revista del grupo de estudio de enfermedades cerebrovasculares de la Sociedad Española de Neurología. Patología vascular infrecuente del sistema nervioso central. 7: 20-25.
Cuadrado MJ, Khamashta MA. (2001). Migraine in Hughes syndrome. Heparin as a therapeutic trial?. Q J Med; 94: 114-5
Emmerich J, Rosendaal FR, Cattaneo M, Margaglione M, De Stefano V, Cumming T, et al. (2001) Combined effect of factor V Leiden and prothrombin 20210A on the risk of venous thromboembolism--pooled analysis of 8 case-control studies including 2310 cases and 3204 controls. Study Group for Pooled-Analysis in Venous Thromboembolism.. Thromb Haemost. 86(3):809-16. Erratum in: Thromb Haemost 2001 Dec; 86(6):1598.
Fields Madeline C, Levine SR. (2005) Thrombophilias and Stroke: Diagnosis, Treatment and Prognosis. Journal of Thrombosis and Thrombolysis; 20 113-126:
Furie K, Kelly PJ, Kistler JP. (2004). Coagulation studies. In; Chaturverdi SR, Levine SR (eds), Transient Ischemic Attacks. Blackwell Futurs Publishing: 214-231.
Gillum LA, Mamidipudi SK, Johnston SC. (2000) Ischemic stroke risk with oral contraceptives: a metaanalysis. JAMA. 284:72-78.
Gómez EB, van Goor MP, Leebeek FW, Brouwers GJ, Koudstaal PJ, Dippel DW. (2002). Elevated prothrombin is a risk factor for cerebral arterial ischemia in young adults. Clin Neurol Neurosurg. 104:285-288.
Group APASS. (1997). Anticardiolipin antibodies and the risk of recurrent thrombo-occlusive events and death. Neurology. 48: 91-4
Heijmans BT, Westendrop RG, Knoop DL et al. (1998). The risk of mortality and the factor V Leiden mutation in a population-based cohort. Thromb Haemost 80: 607.
Hindorff LA, Schwartz SM, Siscovick DS, Psaty BM, Longstreth WT Jr, Reiner AP. (2002). The association of PAI-1 promotor 4G/5G insertion/deletion polymorphism with myocardial infarction and stroke in young women. Cardiovasc Risk; 9: 131-137.
Janardhan V, Wolf PA, Kaser CS, Massaro JM, D´Agostino RB, Franzblau C et al. (2004). Anticardiolipin antibodies and risk of ischemic stroke and transient ischemic attack: the Framingham cohort and offspring study. Stroke. 33: 2396-400.
Jungehulsing GJ, Nolte CH. (2008). Prothrombotic gene variations in ischemic stroke: no difference between large and small vessel disease?. Neuroepidemiology; 31:282.
Kitagawa Y, Ohkuma H, Tokuoka K (2008). Ischemic stroke with antiphospholipid antibody. Brain Nerve; 60: 1144-58.
Kenet G, Lütkhoff L, Albisetti M, Bernard T, Bonduel M, Brandao L. (2010). Impact of Thrombophilia on risk of arterial ischemic stroke or cerebral sinovenous thrombosis in neonates and children. Circulation; 121: 1838-1847.
Kenet G, Sadetzki S, Murad H, Martinowitz U, Rosenberg N, Gitel S et al. (2000). Factor V Leiden and antiphospholipid antibodies are significant risk factors for ischemic stroke in children. Stroke. 31: 1283-8.
MacClellan LR, Mitchell BD, Cole JW, et al (2006). Familial aggregation of ischemic stroke in young women: the Stroke Prevention in Young Women Study. Genet Epidemiol. 30:602-608.
Mateo J, Oliver A, Borrell M (1997). Laboratory evaluation and clinical characteristics of 2132 consecutive unselected patients with venous thromboembolism-results of the Spanish Multicentric Study on Thrombophilia (EMET-study). Thromb Haemost 77:444.
Pezzini A, Grassi M, Iacoviello L. (2007) Inherited thrombophilia and stratification of ischaemic stroke risk among users of oral contraceptives. J Neurol Neurosurg Psychiatry; 78:271-276.
Pruissen MO, Slooter A, Rosendaal FR, Van der Graaf Y and Algra A (2008). Coagulation factor XIII gene variation, oral contraceptives, and risk of ischemic stroke. Blood. 111:1282-1286
Reed DC, Cox M, Clegg JB. (1995) World distribution of Factor V Leiden, Lancet 369: 64-67.
Rodrigues C, Carvalho JF, Shoenfeld Y. (2010). Neurological manifestations of antiphospholipid síndrome. Eur J Clin Invest; 40: 350-359.
Ruiz-Irastorza G, Martínez-Berriotxoa A, Egurbide MV. (2009). The antiphospholipid syndrome in the 21st Century. Med Clin (Barc): 133-136.
Sanjay C, Keswani N (2002). Antiphospholipid syndrome. Review article. Journal of the Royal Society of Medicine; 95.
Suárez-Luis I, Rodríguez-Rodríguez Y, Roussó-Viota T, Cordero-Eiriz A. (2003). Algunas consideraciones acerca de los posibles mecanismos patológicos en el síndrome antifosfolípido e ictus. Rev Neurol. 37: 654-657.
Terashi H, Uchiyama S, Hashimoto S, Miyazaki K, Tsutsumi Y, Yamazaki M et al. (2005). Clinical characteristics of stroke patients with antiphospholipid antibodies. Cerebrovasc Dis. 19: 384-90.
- 45873 lecturas